微波法提取虫草素研究
微波法提取虫草素研究
夏 敏1 ,温 鲁2 、
(1.淮阴师范学院化学系分析测试中心,江苏
淮安 223300; 2.淮阴师范学院生物系,江苏 淮安 223300)
摘 要:对蛹虫草固体培养物中的虫草素进行微波提取,用 HPLC 法测定提取液中的虫草素含量,通过正交试验,
确定了微波提取虫草素的最佳条件为:提取液用量 10ml,固液比 1:200,中火处理 3min,样品中虫草素的测定值 达 12.16mg/g。本法提取时间仅为超声波提取的 1/40,且提取率高于超声波提取。 关键词:微波提取;虫草素;正交试验;HPLC

由表 3 可看出,随着淀粉乙酰基含量的增加,冻 融稳定性随之增加。这是由于醋酸酯化淀粉引入了亲水
的乙酰基团,可以与水分子更好地水合,另一方面与 支链淀粉的脱水葡萄糖羟基形成分子内氢键,阻碍了支 链淀粉分子间氢键生成,分子间空间阻碍增大,使分 子之间不易重新排列和缔合,冻融稳定性得到改善[5]。
3 结 论 制备红薯酯化淀粉的最佳条件为:p H 值为 9.25 、 醋酸酐用量 10.0%、反应温度 2 5℃,反应时间 2.5h,此时反应效率可达 72.59%,醋酸酯化淀粉乙酰基含量 为 3.17% 。通过红外结构表征,验证了酯化反应的发
生。酯化淀粉糊的透光度、溶解度、膨胀率、冻融 稳定性均比原红薯淀粉有明显提高。
参考文献:
[1] 于泓鹏, 朱婉怡, 高群玉, 等. 食用醋酸酯淀粉制备和性质的研究[J]. 食品科学, 2003, 24(7): 51-55.
[2] 孙建平, 吴洪才, 胡友慧. 酯化变性淀粉的制备与应用性能[J]. 高分 子材料科学与工程, 2003, 19(3): 102-105.
[3] Mahmoud Z, Sitohy,Said S EI-Saadony. Physicochemical properties of different types of
starch phosphate monoesters[J]. Starch/Starke, 2000, 52(4): 101-105.
[4] 杜先峰. 野生食品资源葛根的开发和应用-葛根淀粉的研究[J]. 无锡 轻工大学学报, 1999, (25-26): 80-85.
[5] 林丽. 木薯淀粉磷酸酯的结构表征及理化性质研究[D]. 南宁: 广西 大学,
2005. 28-49.
虫草素是蛹虫草的主要活性成分之一,能抑制枯草 杆菌、鸟结核杆菌等,对小鼠艾氏腹水癌、人鼻咽癌 K B 细胞及小鼠 S 180 瘤细胞均有抑制作用[1],有着抗菌、 抗病毒、抗肿瘤,以及抗疲劳、抗衰老、提高人体 免疫力等显著功效,并有明显的雄性激素样作用[2],其 含量多少是衡量虫草品质高低的重要依据。目前对虫草 多采用超声波来提取虫草素[1][3],用高效液相色谱法测定
含量[2,3]。近年来,有人把微波技术用于天然产物的提 取,如李嵘试验用微波法提取银杏黄酮甙[4],陈代武[5] 试验用微波辅助萃取- HPLC 测定洋葱槲皮素等,均有 较好效果。我们用蒸馏水作浸提溶剂,利用家用微波 炉对样品进行微波处理,用 HPLC 法测定提取液中的虫 草素,建立了微波提取- HPLC 法测定蛹虫草固体培养
物中虫草素的新方法。此法简单、快速,提取效率较 超声波大为提高,可在科研和生产实践中使用。
1 材料与方法
1.1 材料
1.1.1 样品与试剂
待测样品 蛹虫草固体培养物3# ,由淮阴师范学院 生物系提供;虫草素对照品
上海化学试剂公司进口分 装;其余所用试剂为国产分析纯;用水为三次蒸馏水。 1.1.2 仪器 KD23B-AE 型微波炉 美的微波炉制造有限公司; KS-300D 型超声波清洗仪
宁波科生仪器厂;电子精密 天平 上海奥豪斯公司;美国 Waters 高效液相色谱仪 系统(600E pump,600controller,2487紫外检测器,InLine Degasser AF 在线脱气机,Empower 色谱数据管理 系统) 美国 Waters 公司;DHG-9240A 型电热恒温鼓风 干燥箱 上海精宏实验设备有限公司;JYL-350 型多功 能食品料理机 山东九阳小家电有限公司;其余仪器均 为实验室常规仪器。
1.2 方法
1.2.1 微波处理预试验
取一批规格相同的试剂瓶,每 6 瓶一组,每瓶加 25ml 自来水,不加塞,在微波炉中围绕圆盘中心均匀 排成 1 圈,保证每瓶接受的微波剂量相同。每组分别用
低火(P10)、中低火(P30)、中火(P50)、中高火(P80)进行 处理,观察到样品在低火下10min 不沸腾,中低火8.0min 不沸腾,中火 3.5min 不沸腾,中高火 2.5min 不沸腾。 以下提取试验,各微波强度所用时间,均不超过该强
度使水沸腾的时间。
1.2.2 微波提取
将蛹虫草固体培养物用 6 0 ℃低温烘干,粉碎,精 密称取培养物粉末 0.2500g,放入试剂瓶中,加 25.00ml
蒸馏水,轻轻摇匀,将瓶塞放在瓶口上(不要塞紧)。每 个样品瓶配 5 瓶盛有 25.00ml 蒸馏水的空白瓶,在微波炉 中排成一圈进行处理。
1.2.2.1 不同微波强度和处理时间试验
微波强度设置为低火、中低火、中火、中高火, 处理时间设置为 0.5、1.0、1.5、2.0、2.5、3、4、 5min。在用微波处理前,每个样品瓶所配 5 瓶空白瓶, 均需凉至室温,以减少试验误差。
1.2.2.2 不同加液量试验
将固液比定为 1:100,依次向 5 个试剂瓶中加入 0.1000、0.2000、0.2500、0.3000 和 0.4000g 样品,再 依次加 10.00、20.00、25.00、30.00、40.00ml 蒸馏水, 配 1 瓶空白瓶,同时用中火处理 2min 。
1.2.2.3 不同固液比试验
将加液量定为 25ml,分别称取 0.5000、0.2500、 0.1670 和 0.1250g 样品,放入 4 个试剂瓶中,每瓶加 25.00ml蒸馏水,各瓶固液比依次为1:50、1:100、1:150、 1:200,配 2 瓶空白瓶,同时用中火处理 2min。
1.2.3 超声波提取
向若干试剂瓶中各加 0.2500g 样品,再加 25.00ml 水,一起放入超声波振荡仪进行超声处理,分别在处 理 3 0、6 0、9 0 和 120min 时取出样品瓶。
1.2.4 微波提取正交试验
根据1.2.2.1、1.2.2.2和1.2.2.3的试验结果,选择微 波强度、处理时间、加液量和固液比四个因子,各取 三个水平,采用 L9( 34)正交表进行正交试验。各因子和 水平见表 1 。

1.2.5 含量测定
1.2.5.1 色谱条件
色谱柱为 Waters Nova-pak C18,3.9mm × 300mm, 4μm;流动相为 K H 2 P O 4 - K 2 HPO 4 缓冲液(0.01mol/L, pH6.86)+1% 四氢呋喃;等度洗脱;流速 1.00ml/min; 柱温为室温;检测波长 260nm 。
1.2.5.2 提取液测定
在选定色谱条件下,取虫草素对照品溶液 1 0μl 进 样分析,色谱图见图 1 ,以峰面积对含量作线性回归, 得回归方程为 Y=4.46e+006X+7.43e+003,r=0.99995。取样品提取液用滤纸过滤,滤液再经 0.2μm 微孔滤膜压 滤,1 0μl 进样分析,色谱图见图 2 。以对照品的保留 时间定性、外标法定量,计算提取液的虫草素含量, 再根据固液比求出样品中的虫草素含量。
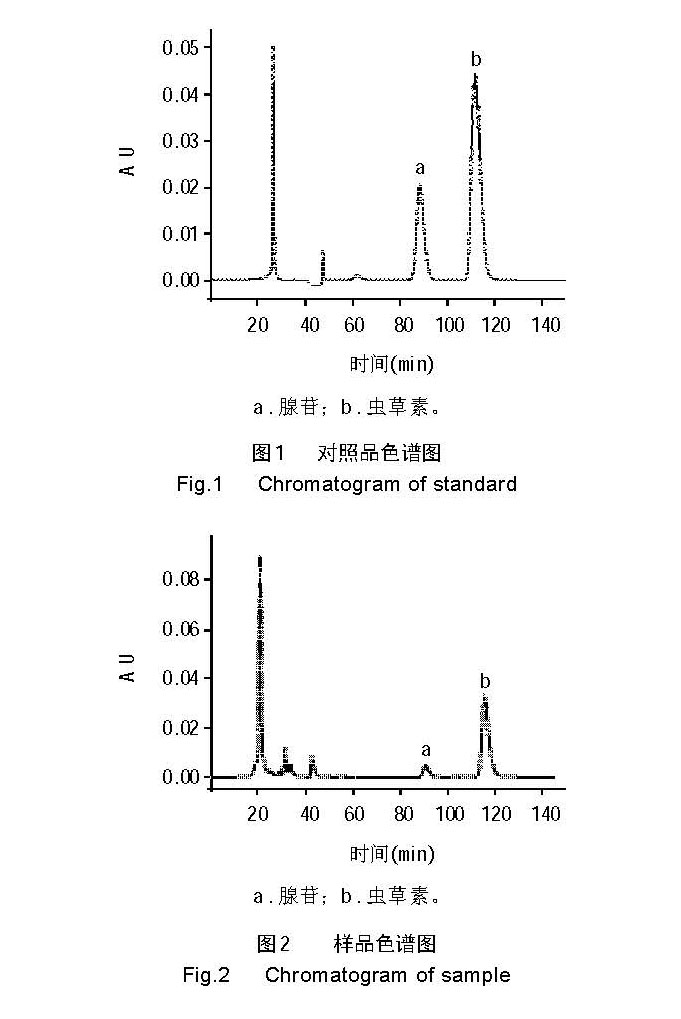
2 结果与分析
2.1 不同微波强度和处理时间的提取效果
提取结果见表 2 。
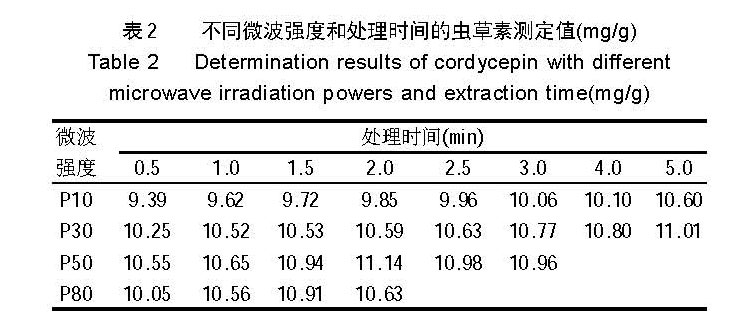
从表 2 可知,用低火和中低火处理,随着处理时 间延长,虫草素提取量逐步增加,若继续延长处理时
间,还将进一步增加,但增加幅度放缓(试验中 P10 已 处理到 10min,P30 处理到 8min,但未在表中列出),且均未超过中火处理的最大值;中火处理在 2min 时出现最 大值,延长处理时间,虫草素提取量有小幅回落;中
高火处理的最大值在 1.5min,但仍低于中火的最大值, 延长时间虫草素提取量并未增加,而液体已接近沸腾。 综合考虑微波强度和处理时间,用中火处理 2 ~3min, 对虫草素的提取最为有利。
2.2 不同加液量的提取效果
提取结果见表 3 。
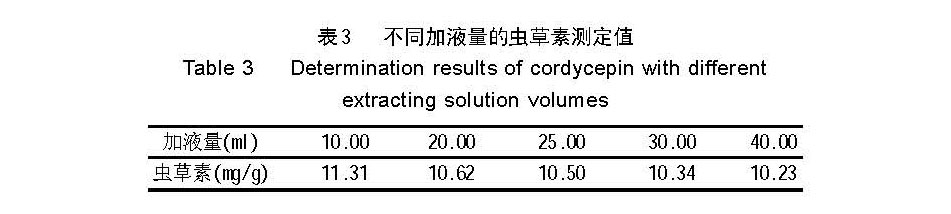
在相同固液比的条件下,随着原料和提取液用量的 增多,单位质量的被处理物所受微波剂量减少,因而 虫草素的提取量降低。上表显示,用10.00ml水对0.1000g 样品进行微波提取,效果最好。
2.3 不同固液比的提取效果
试验结果见表 4 。
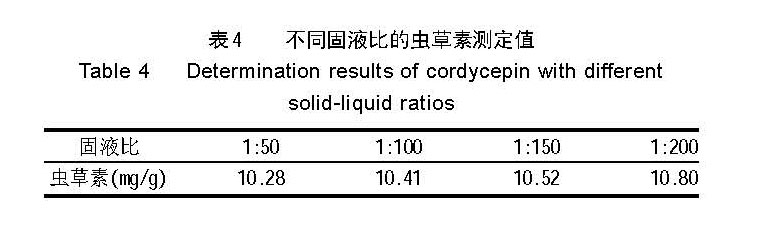
结果表明,不同固液比对虫草素的提取效果有影 响,固液比大,提取效果好,以固液比 1:200 提取虫 草素的效果最好。
2.4 超声波的提取效果
测定结果见表 5 。
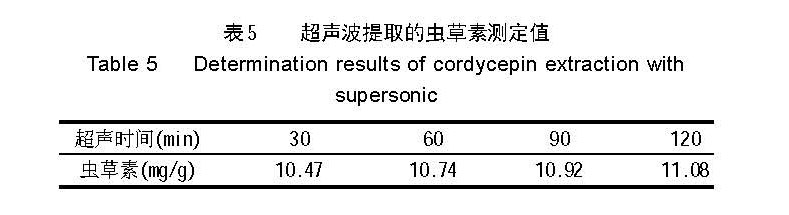
随着超声处理时间的延长,虫草素提取量逐渐增加,但即使处理 120min,也未超过微波中火处理 2min 提取量(在相同固液比和加液量的条件下,见表 2 ),再延长时间已无意义。超声较水浴和回流浸提时间短、提 取率高,但与微波处理相比,微波提取的时间更短、 提取率更高,而且设备更普通( 普通家用微波炉即可使 用) ,具有更好的应用前景。
2.5 微波提取正交试验结果
试验根据四因子三水平设计了 9 个组合,结果和分 析见表 6 。
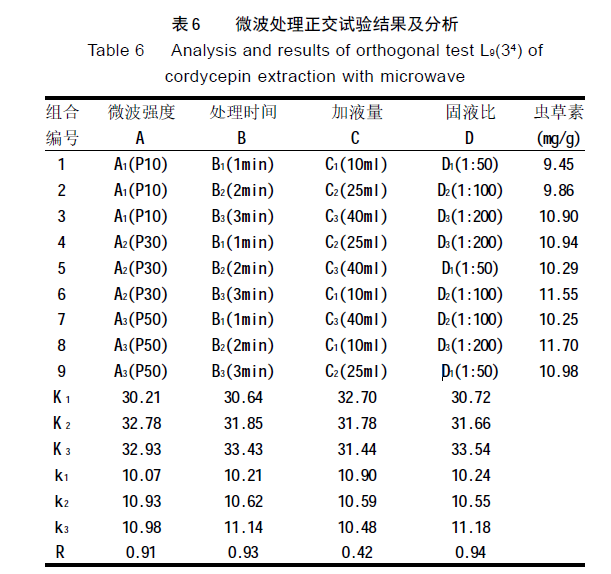
表中各列 K 1~K 3 值为各因子每个水平所得结果(虫 草素测定值)的和,k1~k3 为各因子每个水平的算术平均 值,R 为同一因子 3 个平均值的全距(最大值减最小值)。
由全距可知,加液量最小,为次要因子;固液比、微波处理时间和微波强度均很大,为主要因子,其不同 水平对虫草素的提取有较大影响。
从表 6 还可看出,组合 8(A3B2C1D3)的提取效果最好, 为 11.70mg/g;组合 6(A2B3C1D2)次之,为 11.55mg/g。各 因子的不同水平中,分别以 A 3 、B 3 、C 1 、D 3 为最优 水平,但其组合 A 3 B 3 C 1D 3 未包括在参加试验的 9 个组合 中。为此,加做一个该组合处理,测得虫草素含量为12.16mg/g,证明该组合确是优于 A3B2C1 D3 和 A2 B3C1D2 的最佳组合。
3 讨 论
3.1 用微波提取虫草素,与超声波提取虫草素相比, 具有提取时间短(是超声波提取的1/60~1/40)、提取效果
好、设备简单易得等优点,是比超声波提取更理想的 虫草素提取新方法。
3.2 用 HPLC 测定虫草素,在文中介绍的色谱条件下,
虫草素色谱峰与其它色谱峰得到很好分离,标准曲线的 线性关系也很好,回归系数为 0.99995,结合虫草素的 微波提取法,可用于生产上蛹虫草及其固体培养物的质
量控制和产品检测。
3.3 本研究只对蛹虫草固体培养物进行一次微波处理, 如作两次处理,提取率会更高。
3.4 本研究采用价廉易得的蒸馏水作为虫草素的浸提溶 剂,其它溶剂对虫草素的提取研究将另文报告。
参考文献:
[1] 候淑丽, 赵风阁. 十年来蛹草的成分及药理研究概述[J]. 长春中医 学院学报, 1997, 13(6): 64-66.
[2] 温鲁, 夏敏, 宋虎卫, 等. 固体培养蛹虫草核苷类次生代谢物的产率 [J]. 食品科学, 2005, 26(11): 65-68.
[3] 郭澄, 朱杰, 张纯, 等. 高效液相色谱法测定人工虫草菌丝中腺苷和
虫草素的含量[J] . 中国中药杂志, 1998, 23(4):
236-237.
[4] 李嵘, 金美芳. 微波法提取银杏黄酮甙的新工艺[J]. 食品科学, 2000, 21(3): 39-41.
[5] 陈代武, 李杰红. 微波辅助萃取-HPLC测定洋葱槲皮素技术的研 究[J]. 食品工业科技, 2006, 27(1): 101-103.